Влияние гидролизата коллагена Первый Живой Коллаген как основной биологически активной добавки в пищу на результаты реабилитации у пациентов, перенесших ортопедические вмешательства на крупных суставах нижних конечностях (коленном и тазобедренном)
Ключевые слова: типы коллагена, обмен коллагена, источники получения коллагена, гидролизат коллагена, остеоартроз.

Введение
Остеоартроз (ОА) является основной патологией в структуре заболеваний опорно-двигательного аппарата, по всему миру им страдают более 300 млн. человек, кроме того, это ведущая причина нетрудоспособности среди взрослого населения [1].По прогнозам Всемирной организации здравоохранения, ОА в ближайшие десятилетия станет четвертой главной причиной инвалидности у женщин и восьмой — у мужчин [2], что заставляет искать новые пути профилактики и лечения ОА.
ОА - гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь суставного хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. ОА (в зарубежной литературе остеоартрит, что отражает важную роль воспалительного компонента в течении данного заболевания) характеризуется биохимическими изменениями в клетках и матриксе суставов, что приводит к образованию эрозий, уменьшению толщины суставного хряща и склерозу субхондральной кости. В развитии ОА принимают участие многие факторы, включая генетическую предрасположенность, механические повреждения, возрастные, эндокринные, метаболические факторы [3, 4].
При ОА хондроциты коллагена II типа начинают замещать на коллаген I и III типов, увеличивается синтез неколлагеновых белков, усиливаются процессы распада и деградации за счет роста активности кислых лизосомальных гидролаз. В очагах деструкции суставного хряща при ОА выявляется значительно повышается содержание катепсина - одной из лизосомальных протеиназ, которая расщепляет стержневой белок протеогликанов, что вызывает высвобождение и выведение из матрикса гликозаминогликанов. Считается, что именно этот механизм является ведущим в обеднении хрящевой ткани протеогликанами. При ОА в хряще становится заметной активность коллагенолитических ферментов — матриксных металлопротеиназ, участвующих в катаболизме хрящевого матрикса. Повышенная активность данных ферментов является одним из основных механизмов патогенеза ОА [3, 5, 6].
Коллаген удерживает трехмерную структуру хряща, удерживает аггреканы и противостоит силам растяжения, постоянно воздействующим на хрящ. При ОА уменьшается поступление к хондроцитам строительного материала для биосинтеза коллагена и протеогликанов, веществ и минералов, необходимых для поддержания жизнедеятельности самих хондроцитов, что становится причиной их истощения, снижения функциональной активности и преждевременного апоптоза [5].
С возраста 25 лет синтез коллагена начинает уменьшается. Также изменяется соотношение типов коллагенов в тканях. Коллаген становится более жестким, что приводит к ухудшению состояния всех тканей, содержащих коллаген, включая хрящи суставов. Таким образом, ОА представляет собой патологический процесс, в ходе которого усиливаются катаболические процессы в хряще, снижается синтетическая функция хондроцитов, в том числе за счет дефицита веществ для биосинтеза компонентов хряща, с выработкой недостаточного количества и/или с несвойственными нормальному хрящу качествами протеогликанов (мелкие, низкомолекулярные) и коллагена (короткоцепочечный). В совокупности это приводит к потере хрящевым матриксом гликозаминогликанов и коллагена, деградации хряща, вторичным изменениям в подлежащей кости и других структурных компонентах сустава. Соответственно, лечение ОА направлено на торможение катаболических процессов, например путем применения противовоспалительных препаратов, и стимуляцию анаболической активности хондроцитов. В условиях, когда нет возможности изменить количество хондроцитов, единственным реальным путем повышения их синтетической активности является применение веществ, являющихся субстратами для синтеза гликозаминогликанов и коллагена [7].
В настоящее время не существует одобренных препаратов для лечения ОА, модифицирующих заболевание. В отсутствие эффективной фармакотерапии многие пациенты с ОА обращаются к пищевым добавкам и нутрицевтикам, включая желатин, гидролизованный коллаген и пептиды коллагена. Гидролизаты коллагена и ультрагидролизаты - это термины, используемые для описания коллагенов, которые были расщеплены на мелкие пептиды и аминокислоты в присутствии коллагеназы в условиях высокого давления. Гидролизат коллагена как было неоднократно показано, оказывает анаболическое действие на хрящевую ткань. Его применение может улучшать прогноз у пациентов с ОА [5, 8].
Коллаген — сложный белок, который содержится во многих продуктах питания. Богаты коллагеном мясные волокна, субпродукты, кожа, хрящи животных и рыб. Человеческий организм плохо усваивает целостный белок коллаген из пищи из-за большого размера его молекул. В процессе пищеварения в желудке под воздействием соляной кислоты и пепсина начинается разрушение пептидных связей в молекуле коллагена. В дальнейшем гидролиз коллагена происходит в тонкой кишке под влиянием протеолитических ферментов панкреатического сока. При этом негидролизованный коллаген распадается до уровня пептидов коллагена. Дальнейший гидролиз пептидов уже происходит под воздействием кишечных ферментов до состояния аминокислот, которые всасываются и через систему воротной вены поступают в печень и далее распространяются по всему организму [9, 10, 20] (рис. 1).
Остеоартроз (ОА) является основной патологией в структуре заболеваний опорно-двигательного аппарата, по всему миру им страдают более 300 млн. человек, кроме того, это ведущая причина нетрудоспособности среди взрослого населения [1].По прогнозам Всемирной организации здравоохранения, ОА в ближайшие десятилетия станет четвертой главной причиной инвалидности у женщин и восьмой — у мужчин [2], что заставляет искать новые пути профилактики и лечения ОА.
ОА - гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь суставного хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. ОА (в зарубежной литературе остеоартрит, что отражает важную роль воспалительного компонента в течении данного заболевания) характеризуется биохимическими изменениями в клетках и матриксе суставов, что приводит к образованию эрозий, уменьшению толщины суставного хряща и склерозу субхондральной кости. В развитии ОА принимают участие многие факторы, включая генетическую предрасположенность, механические повреждения, возрастные, эндокринные, метаболические факторы [3, 4].
При ОА хондроциты коллагена II типа начинают замещать на коллаген I и III типов, увеличивается синтез неколлагеновых белков, усиливаются процессы распада и деградации за счет роста активности кислых лизосомальных гидролаз. В очагах деструкции суставного хряща при ОА выявляется значительно повышается содержание катепсина - одной из лизосомальных протеиназ, которая расщепляет стержневой белок протеогликанов, что вызывает высвобождение и выведение из матрикса гликозаминогликанов. Считается, что именно этот механизм является ведущим в обеднении хрящевой ткани протеогликанами. При ОА в хряще становится заметной активность коллагенолитических ферментов — матриксных металлопротеиназ, участвующих в катаболизме хрящевого матрикса. Повышенная активность данных ферментов является одним из основных механизмов патогенеза ОА [3, 5, 6].
Коллаген удерживает трехмерную структуру хряща, удерживает аггреканы и противостоит силам растяжения, постоянно воздействующим на хрящ. При ОА уменьшается поступление к хондроцитам строительного материала для биосинтеза коллагена и протеогликанов, веществ и минералов, необходимых для поддержания жизнедеятельности самих хондроцитов, что становится причиной их истощения, снижения функциональной активности и преждевременного апоптоза [5].
С возраста 25 лет синтез коллагена начинает уменьшается. Также изменяется соотношение типов коллагенов в тканях. Коллаген становится более жестким, что приводит к ухудшению состояния всех тканей, содержащих коллаген, включая хрящи суставов. Таким образом, ОА представляет собой патологический процесс, в ходе которого усиливаются катаболические процессы в хряще, снижается синтетическая функция хондроцитов, в том числе за счет дефицита веществ для биосинтеза компонентов хряща, с выработкой недостаточного количества и/или с несвойственными нормальному хрящу качествами протеогликанов (мелкие, низкомолекулярные) и коллагена (короткоцепочечный). В совокупности это приводит к потере хрящевым матриксом гликозаминогликанов и коллагена, деградации хряща, вторичным изменениям в подлежащей кости и других структурных компонентах сустава. Соответственно, лечение ОА направлено на торможение катаболических процессов, например путем применения противовоспалительных препаратов, и стимуляцию анаболической активности хондроцитов. В условиях, когда нет возможности изменить количество хондроцитов, единственным реальным путем повышения их синтетической активности является применение веществ, являющихся субстратами для синтеза гликозаминогликанов и коллагена [7].
В настоящее время не существует одобренных препаратов для лечения ОА, модифицирующих заболевание. В отсутствие эффективной фармакотерапии многие пациенты с ОА обращаются к пищевым добавкам и нутрицевтикам, включая желатин, гидролизованный коллаген и пептиды коллагена. Гидролизаты коллагена и ультрагидролизаты - это термины, используемые для описания коллагенов, которые были расщеплены на мелкие пептиды и аминокислоты в присутствии коллагеназы в условиях высокого давления. Гидролизат коллагена как было неоднократно показано, оказывает анаболическое действие на хрящевую ткань. Его применение может улучшать прогноз у пациентов с ОА [5, 8].
Коллаген — сложный белок, который содержится во многих продуктах питания. Богаты коллагеном мясные волокна, субпродукты, кожа, хрящи животных и рыб. Человеческий организм плохо усваивает целостный белок коллаген из пищи из-за большого размера его молекул. В процессе пищеварения в желудке под воздействием соляной кислоты и пепсина начинается разрушение пептидных связей в молекуле коллагена. В дальнейшем гидролиз коллагена происходит в тонкой кишке под влиянием протеолитических ферментов панкреатического сока. При этом негидролизованный коллаген распадается до уровня пептидов коллагена. Дальнейший гидролиз пептидов уже происходит под воздействием кишечных ферментов до состояния аминокислот, которые всасываются и через систему воротной вены поступают в печень и далее распространяются по всему организму [9, 10, 20] (рис. 1).

Для полноценного переваривания коллагена пищевых продуктов нужны достаточный уровень соляной кислоты и пепсина в желудке, хорошая внешнесекреторная функция поджелудочной железы и ферментная активность тонкой кишки. При различных заболеваниях желудочно-кишечного тракта, а также у детей и лиц старшего возраста коллаген переваривается плохо. Повлиять на данный процесс можно за счет включения в рацион питания коллагена в форме пептидов. Пептиды коллагена — короткие цепочки, состоящие из двух или трех аминокислот, обладающие меньшей молекулярной массой в сравнении с гидролизованным коллагеном [9, 10].
Есть данные, что в кишечнике могут всасываться короткие пептиды коллагена, состоящие из двух или трёх аминокислот, а не только отдельные аминокислоты. Благодаря использованию пептидов коллагена облегчается процесс переваривания белка в желудочно-кишечном тракте, увеличивается уровень поступления аминокислот в хрящ с дальнейшим их использованием в синтезе коллагена в ходроцитах [5, 11].
В работе Oesseretal. продемонстрировано, что при пероральном приеме гидролизированных форм коллагена его абcорбция повышается до 95 %. Этот уровень отмечается уже через 6 часов после приема. При этом гидролизированная форма коллагена хорошо переносится и его прием не сопровождается побочными эффектами со стороны желудочно-кишечного тракта [12].
Эффективная и безопасная доза коллагена при ОА составляет 10 г. В исследовании, проведенном R.W. Moskowitz (2000), было показано, что ежедневный прием 10 г коллагена эффективно устраняет боль, превосходя по эффективности плацебо. При этом коллаген не вызывает побочных эффектов и хорошо переносится пациентами, страдающими ОА [11].
В проспективном рандомизированном плацебоконтролируемом двойном слепом исследовании K. Clarketal. (2008) [8] с участием 147 спортсменов с болями в суставах, вызванными физической активностью, изучалось влияние гидролизата коллагена на боль и двигательную активность. Все участники были распределены на две группы: 1-я группа (n = 73) получала 10 г гидролизата коллагена, 2-я (n = 74) — плацебо в течение 24 недель.
Результаты исследования продемонстрировали несомненное преимущество гидролизата коллагена в сравнении с плацебо в уменьшении боли в суставах по визуальной аналоговой шкале (ВАШ) как в состоянии покоя, так и при статической и динамической нагрузке. Это позволило авторам сделать вывод о необходимости назначения коллагена для поддержания здоровья суставов, а также для уменьшения боли и улучшения двигательной активности.
В работе A.E. Belloetal. (2006) [13] было установлено, что перорально принимаемый коллаген накапливается в суставном хряще и обеспечивает значимое увеличение синтеза макромолекул внеклеточного матрикса. В четырех открытых и трех двойных слепых исследованиях была показана эффективность и безопасность гидролизата коллагена в уменьшении боли и улучшении функции суставов у пациентов с ОА.
В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании, проведенном S. Kumaretal. (2015) [14] с участием 30 пациентов, страдающих ОА, также подтверждается обезболивающее и противовоспалительное действие пептидов коллагена. В группе пациентов (n = 15), принимающих пептиды коллагена в течение 13 недель, отмечалось значимое снижение боли по шкале WOMAC, ВАШ и улучшение качества жизни по шкале QOL.
Есть данные, что в кишечнике могут всасываться короткие пептиды коллагена, состоящие из двух или трёх аминокислот, а не только отдельные аминокислоты. Благодаря использованию пептидов коллагена облегчается процесс переваривания белка в желудочно-кишечном тракте, увеличивается уровень поступления аминокислот в хрящ с дальнейшим их использованием в синтезе коллагена в ходроцитах [5, 11].
В работе Oesseretal. продемонстрировано, что при пероральном приеме гидролизированных форм коллагена его абcорбция повышается до 95 %. Этот уровень отмечается уже через 6 часов после приема. При этом гидролизированная форма коллагена хорошо переносится и его прием не сопровождается побочными эффектами со стороны желудочно-кишечного тракта [12].
Эффективная и безопасная доза коллагена при ОА составляет 10 г. В исследовании, проведенном R.W. Moskowitz (2000), было показано, что ежедневный прием 10 г коллагена эффективно устраняет боль, превосходя по эффективности плацебо. При этом коллаген не вызывает побочных эффектов и хорошо переносится пациентами, страдающими ОА [11].
В проспективном рандомизированном плацебоконтролируемом двойном слепом исследовании K. Clarketal. (2008) [8] с участием 147 спортсменов с болями в суставах, вызванными физической активностью, изучалось влияние гидролизата коллагена на боль и двигательную активность. Все участники были распределены на две группы: 1-я группа (n = 73) получала 10 г гидролизата коллагена, 2-я (n = 74) — плацебо в течение 24 недель.
Результаты исследования продемонстрировали несомненное преимущество гидролизата коллагена в сравнении с плацебо в уменьшении боли в суставах по визуальной аналоговой шкале (ВАШ) как в состоянии покоя, так и при статической и динамической нагрузке. Это позволило авторам сделать вывод о необходимости назначения коллагена для поддержания здоровья суставов, а также для уменьшения боли и улучшения двигательной активности.
В работе A.E. Belloetal. (2006) [13] было установлено, что перорально принимаемый коллаген накапливается в суставном хряще и обеспечивает значимое увеличение синтеза макромолекул внеклеточного матрикса. В четырех открытых и трех двойных слепых исследованиях была показана эффективность и безопасность гидролизата коллагена в уменьшении боли и улучшении функции суставов у пациентов с ОА.
В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании, проведенном S. Kumaretal. (2015) [14] с участием 30 пациентов, страдающих ОА, также подтверждается обезболивающее и противовоспалительное действие пептидов коллагена. В группе пациентов (n = 15), принимающих пептиды коллагена в течение 13 недель, отмечалось значимое снижение боли по шкале WOMAC, ВАШ и улучшение качества жизни по шкале QOL.
Производство гидролизата коллагена.
Основным источником коллагеновых пептидов являются бычья шкура, кости, свиная кожа или рыбьи кости и рыбья кожа. Морские источники являются альтернативой бычьим или свиным и не связаны с прионами, ассоциируемыми с риском развития бычьей губчатой энцефалопатии (BSE) [15].Традиционное производство гидролизатов коллагена заключается в контролируемом процессе гидролиза для получения растворимых пептидов. Сырье промывается, гомогенизируют и деминерализуют разбавленной минеральной кислотой или щелочью. Сырье экстрагируется в несколько этапов теплой водой. Дальнейшая ферментативная деградация желатина приводит к получению конечного продукта - гидролизата коллагена [16, 17, 18]. После очистки продукт концентрируют и сушат. Наиболее эффективной процедурой удаления остаточных высокомолекулярных пептидов и белков или снижения содержания антигенов в гипоаллергенных формулах является ультрафильтрация [19].
Таким образом, практически все виды коллагена, существующие на рынке - сухого вида или восстановленные из сухого. Исключением является гидролизат коллагена торговой марки «ПЕРВЫЙ ЖИВОЙ КОЛЛАГЕН», «COLLA GEN». Он производится из птицы (курицы) и характеризуется тем, что в отличие от других нутрицевтиков относится к категории Пищевой продукт. Молекулярная масса пептидов коллагена находится в пределах 12-270 кДт, что влияет на усвояемость, которая достигает 98% и не требует дополнительных добавок, например, витамина С. «Первый живой коллаген» содержит все три типа коллагена. Не проходит этапа сушки и не подвергается высоким температурам. В следствие чего не подвергается денатурации.
Данные характеристики стали определяющими в выборе гидролизата коллагена для нашего исследования.
Обзор продуктов коллагена, представленных на российском рынке, приведен в таблице 1.
Основным источником коллагеновых пептидов являются бычья шкура, кости, свиная кожа или рыбьи кости и рыбья кожа. Морские источники являются альтернативой бычьим или свиным и не связаны с прионами, ассоциируемыми с риском развития бычьей губчатой энцефалопатии (BSE) [15].Традиционное производство гидролизатов коллагена заключается в контролируемом процессе гидролиза для получения растворимых пептидов. Сырье промывается, гомогенизируют и деминерализуют разбавленной минеральной кислотой или щелочью. Сырье экстрагируется в несколько этапов теплой водой. Дальнейшая ферментативная деградация желатина приводит к получению конечного продукта - гидролизата коллагена [16, 17, 18]. После очистки продукт концентрируют и сушат. Наиболее эффективной процедурой удаления остаточных высокомолекулярных пептидов и белков или снижения содержания антигенов в гипоаллергенных формулах является ультрафильтрация [19].
Таким образом, практически все виды коллагена, существующие на рынке - сухого вида или восстановленные из сухого. Исключением является гидролизат коллагена торговой марки «ПЕРВЫЙ ЖИВОЙ КОЛЛАГЕН», «COLLA GEN». Он производится из птицы (курицы) и характеризуется тем, что в отличие от других нутрицевтиков относится к категории Пищевой продукт. Молекулярная масса пептидов коллагена находится в пределах 12-270 кДт, что влияет на усвояемость, которая достигает 98% и не требует дополнительных добавок, например, витамина С. «Первый живой коллаген» содержит все три типа коллагена. Не проходит этапа сушки и не подвергается высоким температурам. В следствие чего не подвергается денатурации.
Данные характеристики стали определяющими в выборе гидролизата коллагена для нашего исследования.
Обзор продуктов коллагена, представленных на российском рынке, приведен в таблице 1.

Таблица 1. Сравнительные характеристики продуктов коллагена, представленных на российском рынке.
Цель исследования: изучить влияние гидролизата коллагена «Первый Живой Коллаген» как основной биологически активной добавки в пищу на результаты реабилитации у пациентов, перенесших ортопедические вмешательства на крупных суставах нижних конечностях (коленном и тазобедренном).
Материал и методы: Было выполнено одноцентровое проспективное рандомизированное исследование типа «случай—контроль». Больным проводили общую для всех стандартную восстановительную терапию в сочетании с применением гидролизата коллагена в основной группе и без добавления такового в контрольной. Исследование проводилось на базе Клиники реабилитации ПМГМУ им. Сеченова, г. Москва. Параметры, включая боль в суставах, оценивались с использованием визуальной аналоговой шкалы, подвижность как угол активного сгибания в оперированном суставе, исходная тяжесть течения заболевания оценивалась по шкалам WOMAC, оценивался индекс тяжести коксартроза и гонартроза по M. Lequene. Оценка производилась в начале госпитализации и по окончании курса приема препарата гидролизата коллагена.
Участники исследования: В период с марта 2022 г. по июнь 2022 г. было набрано 38 пациентов, проходивших курс реабилитации в условиях стационарного отделения Клиники реабилитации ПМГМУ им. Сеченова. Данные 31 из 38 пациентов могли быть статистически оценены. Курс реабилитации был стандартизирован и включал в себя общепринятые методы: физиотерапевтическое лечение (электростимуляция основных мышечных групп оперированной конечности (№10)), лечебную физкультуру согласно клиническим рекомендациям союза реабилитологов России, пассивную механотерапию в целях мобилизации оперированного сустава (№10), с целью плавного увеличения угла сгибания в оперированном суставе. Контрольную группу составило 30 пациентов, получавших аналогичное лечение в условиях стационара, состояние пациентов данной группы было оценено через 1 месяц после выписки, что соответствовало окончанию курса приема гидролизата коллагена основной группы.
Общими критериями включения пациентов в исследование для всех групп наблюдения были:
- возраст старше 18 лет;
- перенесенное ТЭТС или ТЭКС в срок до 6 месяцев до момента включения в исследование.
Характеристики групп пациентов представлены в таблице 2.

Основные итоговые показатели: Основным параметром эффективности было изменение оценки боли по ВАШ по сравнению с исходным уровнем, а также объективное увеличение подвижности в оперированном суставе.
Размер выборки рассчитывался для уровня значимости 0,05, мощности критерия 0,8 и предполагаемого дельта-эффекта 0,9. Для анализа полученных данных были использованы методы описательной статистики (число пациентов, среднее значение, доверительный интервал, минимальные и максимальные значения, стандартное отклонение, стандартная ошибка), для сравнения групп больных — методы непараметрической статистики, в частности U-критерий Манна—Уитни. Статистическая обработка данных была выполнена с использованием свободного программного обеспечения EpiInfo, поддерживаемого Центром по контролю и профилактике заболеваний (CentersforDiseaseControlandPrevention, США).
Размер выборки рассчитывался для уровня значимости 0,05, мощности критерия 0,8 и предполагаемого дельта-эффекта 0,9. Для анализа полученных данных были использованы методы описательной статистики (число пациентов, среднее значение, доверительный интервал, минимальные и максимальные значения, стандартное отклонение, стандартная ошибка), для сравнения групп больных — методы непараметрической статистики, в частности U-критерий Манна—Уитни. Статистическая обработка данных была выполнена с использованием свободного программного обеспечения EpiInfo, поддерживаемого Центром по контролю и профилактике заболеваний (CentersforDiseaseControlandPrevention, США).
Результаты
Были оценены данные пациентов (n = 31), четыре параметра показали статистически значимые изменения при приеме пищевой добавки гидролизат коллагена (CH) по сравнению с контрольной группой, за исключением боли в покое, которая оказалась примерно одинаковой в обеих группах (1,9 и 2,0 балла). Боль в суставах при ходьбе (-5,0 против - 4,2, р = 0,011), боль в суставах при статической нагрузке (стояние на ногах более 10 минут) (-5,1 против -4,3, р = 0,008), боль в суставах при подъёме по лестнице (-5,9 против -4,9, р = 0,006), боль в суставах при спуске по лестнице (-4,8 против -4,6, р = 0,033).

Таблица 3. Объективное изменение подвижности коленного сустава.

Таблица 4. Динамика болевого синдрома по ВАШ в основной и контрольной группах пациентов.
Обсуждение:
Проблема остеоартроза остается одной из актуальных и нерешенных проблем современной медицины. Это обусловлено значительной распространенностью данной патологии среди людей средней и старшей возрастных групп, идиопатичностью многих механизмов патогенез и социальными последствиями, возникающими у пациентов: снижением качества жизни, социальной дезадаптацией, длительным нарушением трудоспособности и инвалидизацией.
При воздействии различных этиологических факторов возникает нарушение адаптации суставного хряща к механической нагрузке, приводящее к изменению обмена и синтетической активности хондроцитов, а также физико-химическому повреждению его матрикса, основными структурными элементами которого являются коллаген и протеогликаны (аггреканы).
При ОА отмечается уменьшение размера молекул протеогликанов, разволокнение и расщепление матрикса, нарушение процессов диффузии метаболитов. Также наблюдаются дегидратация, дезорганизация и разрыв коллагеновых волокон. Это объясняет целесообразность применения средств, содержащих коллаген, при ОА.
Коллаген в процессе пищеварения распадается до аминокислот, которые используются для синтеза хрящевого коллагена в хондроцитах. Этот коллаген впоследствии встраивается во внеклеточный матрикс суставного хряща.
Открытым остается вопрос эффективности применения гидролизированного коллагена в реабилитации.
При воздействии различных этиологических факторов возникает нарушение адаптации суставного хряща к механической нагрузке, приводящее к изменению обмена и синтетической активности хондроцитов, а также физико-химическому повреждению его матрикса, основными структурными элементами которого являются коллаген и протеогликаны (аггреканы).
При ОА отмечается уменьшение размера молекул протеогликанов, разволокнение и расщепление матрикса, нарушение процессов диффузии метаболитов. Также наблюдаются дегидратация, дезорганизация и разрыв коллагеновых волокон. Это объясняет целесообразность применения средств, содержащих коллаген, при ОА.
Коллаген в процессе пищеварения распадается до аминокислот, которые используются для синтеза хрящевого коллагена в хондроцитах. Этот коллаген впоследствии встраивается во внеклеточный матрикс суставного хряща.
Открытым остается вопрос эффективности применения гидролизированного коллагена в реабилитации.
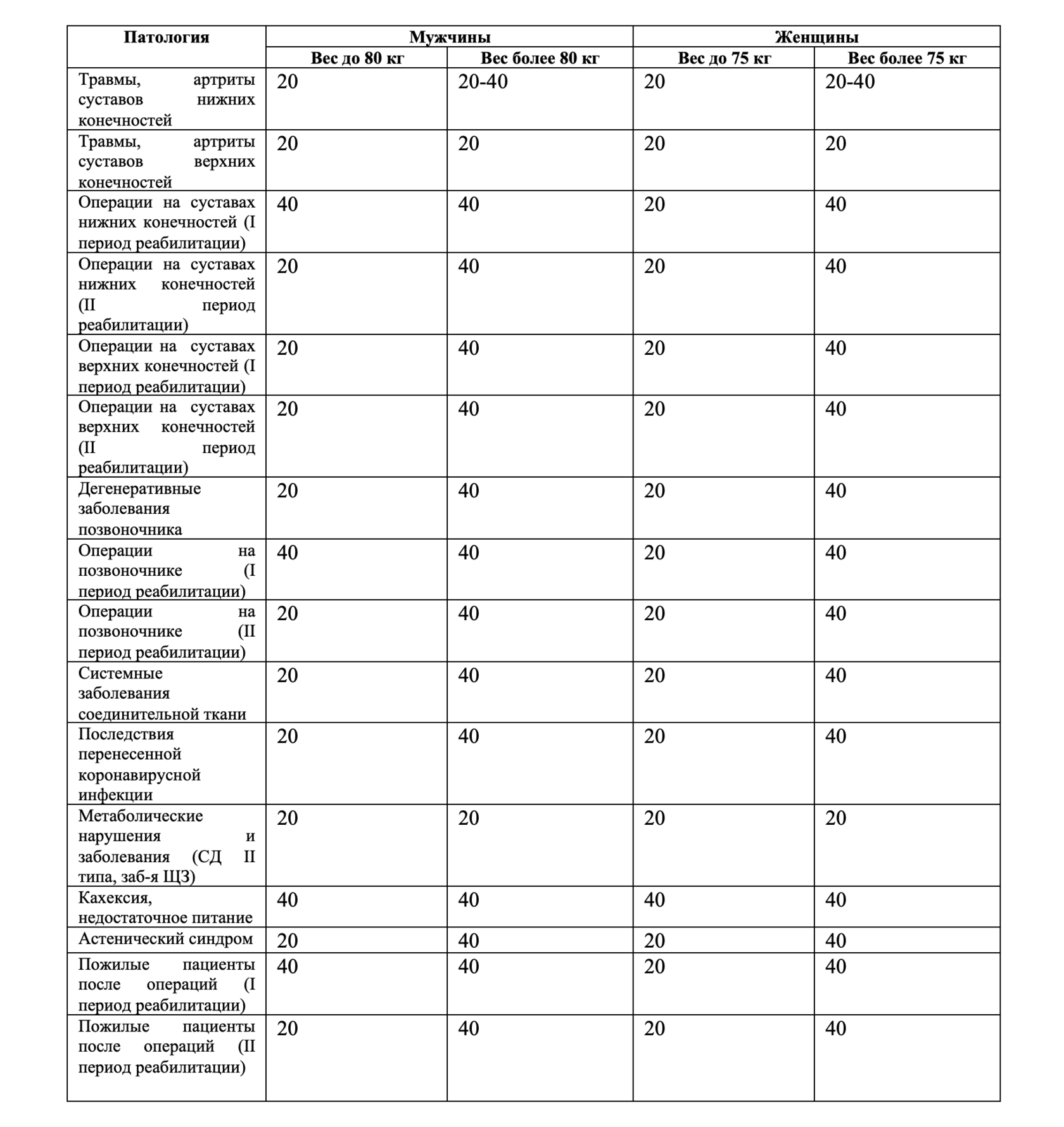
Таблица 5. Потребление гидролизата коллагена в зависимости от вида патологии, пола, веса и возраста (грамм в сутки).
Эффективность и безопасность гидролизированного коллагена и пептидов коллагена при ОА показаны в многочисленных клинических исследованиях. Достижение позитивных изменений в структуре хряща при остеоартрозе, достижение эффективного уровня уменьшения боли, улучшение показателей физической активности и качества жизни возможны при использовании коллагена в 2 – 3 суточных дозах (суточная доза 10 г) на протяжении 1–3 месяцев.
Однако, глубокий анализ отечественных и зарубежных научных работ, а также результаты нашего исследования, показали, что минимальная эффективная суточная доза гидролизата коллагена составляет 20 г. В условиях повышенной потребности в макронутриентах и компонентах гидролизата коллагена, что наблюдалось у пациентов в I и II периоды реабилитации после перенесенных вмешательств, а также у коморбидных пациентов, пациентов с пониженной массой тела, целесообразно увеличить потребление гидролизата коллагена до 40 г в сутки, а в некоторых случаях и более. В зависимости от вида патологии, пола, веса и возраста были разработаны протоколы применения гидролизата коллагена. В таблице 5 представлено потребление гидролизата коллагена в граммах в сутки.
Однако, глубокий анализ отечественных и зарубежных научных работ, а также результаты нашего исследования, показали, что минимальная эффективная суточная доза гидролизата коллагена составляет 20 г. В условиях повышенной потребности в макронутриентах и компонентах гидролизата коллагена, что наблюдалось у пациентов в I и II периоды реабилитации после перенесенных вмешательств, а также у коморбидных пациентов, пациентов с пониженной массой тела, целесообразно увеличить потребление гидролизата коллагена до 40 г в сутки, а в некоторых случаях и более. В зависимости от вида патологии, пола, веса и возраста были разработаны протоколы применения гидролизата коллагена. В таблице 5 представлено потребление гидролизата коллагена в граммах в сутки.
Заключение:
Нами было проведено первое клиническое исследование, в котором было показано улучшение реабилитационного прогноза у пациентов, перенесших оперативное вмешательство на крупных суставах нижних конечностей и получавших пищевую добавку гидролизат коллагена. Результаты этого исследования имеют значение для использования гидролизата коллагена для поддержания здоровья суставов и, возможно, снижения риска ухудшения состояния суставов в группе высокого риска. Несмотря на масштаб и ограничения исследования, результаты показывают, что у пациентов, потребляющих гидролизат коллагена, снижается субъективное восприятие боли как в покое, так и при физических нагрузках, а также объективно увеличивается объем движений в оперированном суставе, что оказывает положительное влияние на результаты реабилитации после перенесенных ортопедических вмешательств. Для подтверждения этих выводов необходимы будущие исследования.
Директор Центра Медицинской Реабилитации. Заведующий стационарным отделением Клинического центра Первого МГМУ им. И.М. Сеченова. Врач травматолог-ортопед.
Терновой К.С.
ЛИТЕРАТУРA/REFERENCES
- Dynamics of Bone and Cartilage Metabolism (Second Edition). 2006, Pages 3-40.
- National Health Interview Survey, United States, 2013–2015.
- Jordan J.M., Helmick C.G., Renner J.B. et al. Prevalence of knee symptoms and radiographic and symptomatic knee osteoarthritis in African Americans and Caucasians: the Johnston County Osteoarthritis Project. J. Rheumatol. 2007. № 34. Р. 172-180.
- Lawrence R.C., Felson D.T., Helmick C.G. et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II. Arthritis Rheum. 2008. № 58. Р. 26-35.
- Dybka K., Walczak P. Collagen hydrolysates as a new diet suplement. Food Chemistry andBiotechnology. 2009. Vol. 73. № 1058.
- Wandel S., Jüni P., Tendal B. et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010. № 341. c4675.
- Яременко О.Б., Анохина Г.А., Бурьянов А.А. Сустав. Хрящ. Коллаген. Травма, Том 21, № 4, 2020.
- Kristine L Clark , Wayne Sebastianelli, Klaus R Flechsenhar, Douglas F Aukermann, Felix Meza, Roberta L Millard, John R Deitch, Paul S Sherbondy, Ann Albert. 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain.Curr Med Res Opin. 2008 May;24(5):1485-96.
- Lippincott Illustrated Reviews: Biochemistry. LWW; Eighth, North American edition (April 20, 2021).
- Северин Е.С., Алейникова Т.Л., Осипов Е.В., Силаева С.А. Биологическая химия. — М.: ООО «Медицинское информационное агентство», 2008.
- Moskowitz R.W. Role of collagen hydrolysate in bone and joint disease. Semin.Arthritis Rheum. 2000. № 30. Р. 87-99.
- Oesser S., Seifert J., Adam M., Babel W. Oral administration of 14C labeled collagen hydrolysate leads to an accumulation of a radioactivity in cartilage of mice (C57/BL). J. Nutr.1999. № 129. Р. 1891-1895.
- Bello A.E., Oesser S. Collagen Hydrolysate for the Treatment of Osteoarthritis and Other Joint Disorders: A Review of the Literature. Curr.Med. Res. Opin. 2006. № 22(11). Р. 2221-32. doi: 10.1185/030079906X148373
- Kumar S., Sugihara F., Suzuki K., lnoue N., Venkateswarathirukumara S. A double-blind, placebo-controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis.Sci Food Agric. 2015.№ 95 (4).Р. 702- 707. doi: 10.1002/jsfa.6752.
- Karim A.A., Bhat R.: Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins. Food Hydroc.23, 563-576, (2009).
- Moskowitz R.W.: Role of collagen hydrolysate in bone and joint disease. Semin.ArthritisRheum. 30, 87-99, (2000).
- Swiderski F., Czerwonka M., Waszkiewicz-Robak B.: Hydrolizatkolagenunowoczesnysuplementdiety. Przem.Spoz.4, 42-44, (2009).
- Zague V.: A new view concerning the effects of collagen hydrolysate intake on skin properties. Arch. Derm. Res. 300, 479-483, (2008).
- Clemente A.: E)nzymatic protein hydrolysates in human nutrition. Trends Food Sci.Techn.11, 254-262, (2000).
- Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res. (Hoboken). 2012. № 64. Р. 465-474.
- Ревматология: Национальное руководство. Под ред.Е.Л. Насонова, В.А. Насоновой. M.: ГЭОТАР-Медиа, 2010.720 с.
- Советников Н.Н., Кальсин В.А., Коноплянников М.А., Муханов В.В. Клеточные технологии и тканеваяинженерия в лечении дефектов суставной поверхности.Клиническая практика. 2013. № 3. С. 52-66.
- Родичкин П.В.,Шаламанов Н.С. Клиническая фармакология хондропротекторов. Обзоры по клиническойфармакологии и лекарственной терапии. 2010. Т. 10. № 3.С. 18-27.
